Cтраница 1
Химический состав речных вод характеризуется обычно соотношением.
Заканчивая характеристику химического состава речных вод необходимо отметить, что они являются основным источником хозяйственного питьевого водоснабжения городов и населенных пунктов республики. При этом важное эколого-гигиеническое значение, наряду с химическим составом, имеет микрокомпонентный (биологически активные F, В, Вг, I и др.) состав воды. Белая в ее среднем и нижнем течении [ Попов, Абдрахманов, 1979 ], так как важную роль в процессах жизнедеятельности играет фтор, поступающий в организм человека главным образом с питьевой водой. Физиологическое качество воды ухудшается как при повышенном содержании фтора, так и при слишком малом его количестве. Установлено, что у людей в течение длительного времени использующих для питья воду с содержанием фтора свыше 1 5 мг / л развивается флюороз, который приводит к полному разрушению зубов.
Коррозия металла в естественных водных средах (речной и морской воде) определяется химическим составом речной воды.
Основой для выделения данных областей и зон явилась совокупность физико-географических условий, с которыми тесно связан химический состав речной воды. Большое значение для величины минерализации речной воды, как известно, имеют климатические условия и в первую очередь увлажненность местности. Увлажненность определяет не только баланс влаги, но и характер выветривания горных пород, тип почвообразовательного процесса, направление циркуляции грунтовых вод, интенсивность, биологических процессов и целый ряд других явлений, с которыми связано формирование химического состава природных вод. Однако если между минерализацией и увлажнением существует довольно ясная обратная зависимость, то связь показателя ионного стока с увлажнением, как уже указывалось выше, более сложная.
Как было видно, целый ряд физико-географических факторов, от которых зависит водный сток, одновременно влияет и на формирование химического состава речной воды.
Следует отметить, что химический состав речных и озерных вод отличается большой изменчивостью во времени, так как зависит от целого ряда беспрерывно изменяющихся факторов. Химический состав речной воды определяется прежде всего составом тех вод, которые питают данную реку. Весной река получает большое количество вод поверхностного стока, летом же такие воды поступают в реку только периодически, во время дождей, в остальное время река питается грунтовыми водами.
Для рек характерна непрерывная смена воды, в результате чего речные воды относительно мало испаряются и сравнительно слабо воздействуют на перемытые ранее грунты речного ложа, но интенсивно взаимодействуют с атмосферным воздухом. Эти условия определяют следующие особенности химического состава речных вод (Алекин, 1970): 1) малую по сравнению с другими водными объектами минерализацию; 2) быструю изменяемость, происходящую под влиянием гидрометеорологических условий; 3) слабое воздействие на ионный и газовый состав биологических процессов и нередко значительное содержание органических веществ; 4) постоянное присутствие в воде растворенных газов, находящихся в атмосфере, и ничтожно малое количество газов, не находящихся в ней.
Что касается тропических зон, то, хотя высокая увлажненность потенциально способствует интенсивной химической эрозии, многовековое промывание создает обедненность грунтов способными растворяться веществами. К сожалению, ограниченность материала-не позволяет еще составить детальной картины формирования химического состава речных вод в тропических зонах. Но имеющиеся аналитические сведения о водах рек тропиков указывают на очень малую минерализацию речных вод, приближающуюся к минерализации вод крайнего Севера.
Организация наблюдений над химическим составом вод всех водных объектов территории СССР, учитывая, что рек длиной более Ю км насчитывается свыше 40000, затруднительна, да и вряд ли необходима. Характерность и в определенных границах некоторая общность физико-географических условий, определяющих формирование химического состава речной воды, позволяют экстраполировать сведения, имеющиеся для соседних районов, а значит, и дать с известным приближением удовлетворительную гидрохимическую характеристику значительной части рек.
Основными характеристиками выноса растворенных солей с данной территории являются величины среднемноголетнего годового ионного стока и его показателя. Для расчета этих величин необходимы сведения как по многолетнему водному стоку, так и по химическому составу речной воды за возможно более длительный период наблюдений. Решение этой задачи стало возможным лишь за последние 10 - 20 лет, благодаря накопленному гидрохимическому материалу в гидрологической сети Гидрометеослужбы СССР. К сожалению, полнота сведений о химическом составе речных вод во много раз уступает полноте сведений о водном стоке.
Страницы: 1
Cтраница 1
Состав речных вод определяется количеством и качеством поступающих в них веществ из почвы и воздуха, а также сточных вод от промышленных и коммунальных предприятий.
Классификация состава речной воды, приведенная на рис. 3.24, является упрощенной и не всегда соответствует действительности.
Как показали многолетние исследования состава речной воды, регулируемый сброс вод накопителя не вызывает сколько-нибудь заметных изменений в качестве речной воды, которые могут быть установлены современными методами анализа.
Отмеченные сезонные особенности изменения состава речных вод следует учитывать при проектировании оборудования. Каждый класс по преобладающему катиону подразделяется на три группы: кальциевую, магниевую и натриевую. В свою очередь каждая группа подразделяется на четыре типа вод, определяемых количественным соотношением ионов. Кроме указанных катионов, речные воды содержат также ионы К, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 и в меньших концентрациях ряд других ионов.
Чтобы выяснить характер изменения свойств и состава речной воды при движении по нефтеносным пластам, в 1957 г. сотрудники ТатНИПИнефть открыли пять нагнетательных скважин на самоизлив.
Вблизи населенных пунктов и промышленных предприятий на состав речной воды большое влияние могут оказывать промышлен-но-бытовые стоки.
Из приведенных в табл. 3 цифр видно, что состав речных вод меняется в довольно широких пределах. Речные воды, которые текут по увлажненным районам, в изобилии содержат карбонаты и значительное количество кальция. Речные воды, которые текут по засушливым районам (например, по западной части США), содержат больше сульфатов, меньше кальция и значительно меньше карбоната. Было бы неправильно обойти молчанием количество органического вещества, которое переносится водами, поскольку это вещество в конце концов превращается в нефть.
Химический состав подземных вод береговых водозаборов обычно в той или иной степени отражает состав речных вод, который, в свою очередь, определяется составом атмосферных осадков, а также составом снегового, ливневого и подземного стоков. В атмосфере дождевые воды и снег обогащаются в небольшом количестве кислородом, углекислым газом, окисью азота, солями аммония, а в загрязненном воздухе промышленных районов, как отмечалось выше, к ним добавляются пыль, бактерии, сера, продукты сгорания угля и нефти и другие вещества.
В результате, поступающие в реку даже сравнительно небольшие количества загрязненных сточных вод вызывают такое ухудшение состава цеженных речных вод, которое исключает возможность дальнейшего цх использования.
Они встречаются в виде минералов, напр, гипс Са8О4 - 2Н2О, мирабилит На28О4 - 10Н2О, а также входят в состав морской и речной воды.
Поверхностные речные воды (а также озерные и прудовые) характеризуются изменчивостью своего состава, происходящей в результате жизнедеятельности находящихся в воде растительных и животных организмов, а главным образом весенних паводков и дождей, смывающих с берегов значительные количества частиц почвы. Наконец, вблизи населенных пунктов на состав речной воды нередко оказывает значительное влияние спуск сточных вод и отходов промышленных предприятий.
Химический состав рек испытывает сезонные колебания. Наибольшая минерализация речной воды наблюдается зимой во время питания рек грунтовыми водами, наименьшая - обычно во время половодья, сезона дождей или питания от таяния ледников. Состав речных вод зависит от физико-географических условий. В зонах избыточного увлажнения минерализация вод небольшая. Изменяется минерализация также вдоль течения реки в зависимости от ее притоков, водосбор которых находится в других условиях формирования.
Состав речной воды, как и ее расход, зависит от времени года. Наименьшая мутность и наибольшая минерализация наблюдаются в зимнее время, обратная картина - в периоды паводков, особенно весенних. В остальное время года на состав речной воды влияют метеорологические условия, летние паводки и другие факторы.
Необходимо обеспечение требуемого для содержащихся в аквариуме рыб, беспозвоночных и растений химического состава воды. При этом вы должны учитывать все факторы, необходимые для поддержания в аквариуме здоровой среды.
Для того чтобы самым эффективным образом добиться такого результата, вам необходимо понимание основных характеристик воды - кислотности (pH), жесткости, солености и т. д. Почти всегда проверить их бывает довольно просто с помощью измерительных приборов или цветных индикаторов. Работа с ними несложна даже для неопытных аквариумистов.
Вода (Н 2 O)
«Чистая вода» - это вещество с хорошо известной всем формулой Н 2 O. Это значит, что ее молекула состоит из двух атомов водорода и одного атома кислорода Молекулы воды электрически нейтральны, т.е. не несут ни положительного, ни отрицательного заряда.
С точки зрения аквариумиста интересен тот факт, что молекулы воды способны распадаться на заряженные частицы - ионы. Положительно заряженные ионы называются катионами, отрицательно заряженные - анионами. Молекулы воды распадаются на положительно заряженные ионы водорода (Н +) и отрицательно заряженные гидроксильные группы (ОН —). Это важно, поскольку эта диссоциация воды влияет на ее способность растворять присутствующие в аквариуме минеральные соединения и другие химические вещества. Высокое содержание растворенных в аквариумной воде минеральных веществ часто нежелательно и может быть опасным для здоровья рыб.
Водопроводная и дождевая вода
В водопроводной воде содержится очень много разнообразных веществ, в том числе кальций, магний, натрий и микроэлементы (медь, железо и др.). В ней также может быть довольно много дезинфицирующих добавок - хлора и хлорамина, а также фтористых соединений и веществ, уменьшающих ее жесткость.
Дождевая вода также содержит множество примесей - она растворяет химические вещества, стекая с крыш, проходя по трубам, смешиваясь с пылью. Часто на землю выпадают кислотные дожди - результат загрязнения водяных паров в атмосфере ядовитыми газами, выбрасываемыми промышленными предприятиями и автомобилями. Эти дожди могут растворять содержащиеся в почве соединения кальция, магния и калия. И это еще не все - в воду могут попадать такие токсичные металлы, как ртуть, алюминий, цинк и марганец, причем их количества иногда бывает достаточно, чтобы погубить рыбу в реках, озерах и водохранилищах.
Кислотность воды
Кислотность воды выражается водородным показателем (pH) и определяется содержанием в ней водородных ионов. Значение pH 7 соответствует нейтральной реакции воды, меньше 7 - кислой и выше 7 - щелочной. Кислоты увеличивают содержание в воде ионов водорода и, таким образом, повышают ее кислотность; щелочи уменьшают их содержание и увеличивают щелочность воды. Большинство видов рыб прекрасно живет при значениях pH от 6 до 7,5, но есть виды, которым требуется более кислая или более щелочная вода. Будьте внимательны при определении pH, учитывайте, что pH - это логарифмический показатель. Это значит, что снижение значения pH с 6 до 5 будет означать десятикратное увеличение концентрации водородных ионов, а это - очень существенное изменение химизма воды.
На уровень pH воды в аквариуме влияют общие условия и, в частности, содержание в ней углекислоты. Поэтому вы должны очень внимательно следить за состоянием воды - ведь даже небольшой сдвиг pH может оказаться опасным для обитателей аквариума. Это особенно относится к мягкой, кислой воде, где вообще концентрация водородных ионов выше, чем в жесткой воде. Резкое повышение или понижение pH (так называемые колебания pH) может привести к утрате рыбами способности регулировать содержание солей в организме. Следствием этого может быть тяжелый стресс, нарушение координации движений, а в крайнем случае и нарушение деятельности внутренних органов и гибель.
В густо засаженном аквариуме происходит активное поглощение растениями углекислого газа и нитратов, что приводит к постоянному понижению концентрации водородных ионов и, следовательно, к увеличению значения pH. Это будет происходить до тех пор, пока вы не предпримете меры для увеличения содержания в воде углекислого газа. В аквариумах со скудной растительностью отмечается тенденция к увеличению содержания потенциально опасных нитратов и снижению pH и щелочности.
Углекислый газ (СO 2)
Углекислый газ - один из продуктов обмена большинства живых существ. Растения могут использовать его. В ходе называемого фотосинтезом процесса они поглощают углекислый газ и образуют необходимые для них органические соединения, выделяя жизненно важный для всего живого кислород.
Колебания уровня pH
Ночью, когда вы выключаете в аквариуме свет, фотосинтез прекращается, но растения продолжают дышать, выделяя углекислый газ и поглощая кислород.
Накопление в воде углекислоты приводит к росту концентрации водородных ионов и, следовательно, к увеличению кислотности воды и снижению значения pH. Днем же, когда аквариум освещается, возобновляется фотосинтез и происходят обратные изменения воды. Эти изменения известны под названием колебаний pH.
Снижение содержания углекислого газа в течение дня способствует процессу «биогенной декальцификации», при котором растения пытаются получать углекислоту непосредственно из карбоната кальция (минерального вещества, которым богата жесткая вода).
В итоге на листьях образуется слой извести, который со временем может погубить растение. Для борьбы с этим явлением используются фильтры с дождевальными установками.
Жесткость и щелочность воды
Жесткость воды определяется содержанием в ней растворенных минеральных веществ. Разные соединения обусловливают различные типы жесткости: карбонаты (СО 3 2-), бикарбонаты (НСО 3 —) и гидроксилы (ОН —) определяют так называемую карбонатную жесткость (° КН, или «щелочность»), сульфаты (SO 4 2-), хлориды (Сl —) и нитраты (NO 3 2-) - некарбонатную жесткость (° NKH). Общая жесткость воды (° GH) складывается из ее карбонатной и некарбонатной жесткости,
Подчеркнем, что в данном контексте термин «щелочность» выступает синонимом карбонатной жесткости и не относится к высоким значениям pH.
Из всех перечисленных минеральных веществ наибольшее значение имеют бикарбонаты. Благодаря своей способности связывать или высвобождать водородные ионы они помогают стабилизировать уровень pH аквариумной воды. Способность воды поддерживать постоянное значение pH называется ее буферной емкостью.
Временная и постоянная жесткость
Жесткость воды, определяемую карбонатами и бикарбонатами кальция и магния, называют еще временной: кипячение воды меняет растворимость этих веществ, и они выпадают в виде твердого осадка, вызывая, например, образование накипи на стенках чайника. Таким образом, при подготовке воды для заливки в аквариум временную жесткость можно легко устранить кипячением.
Кипячение, однако, не устраняет постоянную жесткость, обусловленную другими минеральными веществами (особенно сульфатом кальция). Для их удаления воду необходимо подвергнуть деионизации с помощью ионообменных или осмотических фильтров.
Уровни жесткости
Для простоты величину жесткости любого типа выражают в миллиграммах карбоната кальция (СаСO 3) в 1 л воды. В Великобритании жесткость воды выражают в градусах Кларка (1° Кларка = 14,3 мг СаСО 3 в 1 л), хотя чаще просто указывают содержание СаСO 3 в мг/л воды. В США измерение ведут в градусах жесткости (1° жесткости = 1 мг СаСО 3 в 1 л). В последнее время для описания жесткости и щелочности все чаще пользуются миллиэквивалентами (мэкв) (1 мэкв = 50 мг СаСО 3 в 1 л воды). Немецкие градусы жесткости (° dH) определяются по содержанию в воде оксида кальция (а не карбоната кальция); в пересчете 1° dH = 17,9 мг СаСO 3 в 1 л воды.
Уровень жесткости аквариумной воды принято описывать следующими характеристиками:
Очень мягкая - менее 10 мг CaCO 3 в 1 л.
Мягкая - 10-100 мг СаСO 3 в 1 л.
Жесткая - 100-200 мг СаСO 3 в 1 л.
Очень жесткая - больше 200 мг СаСO 3 в 1 л.
Некоторые виды рыб не переносят резких изменений pH, другие страдают в мягкой воде или в воде с низкой щелочностью. В такой непригодной для них воде у рыб могут развиваться поражения чешуи, появляться эрозии на плавниках, может замедляться рост и вообще они будут плохо себя чувствовать.
Микроэлементы
Микроэлементы - это минеральные вещества, содержащиеся в воде в чрезвычайно малых («следовых») количествах. Для аквариумистов особый интерес представляют те из них, которые необходимы для нормальной жизнедеятельности рыб и растений. К числу таких микроэлементов относятся кобальт, йод, железо, медь и селен. Обычно они содержатся в аквариумной воде; кроме того, их добавляют во многие искусственные корма.
Содержание в аквариумной воде микроэлементов можно определить только с помощью сложно устроенных приборов. Многие любители так никогда и не добавляют их в воду и на состояние рыб не жалуются. Однако если у вас в аквариуме мягкая, кислая вода, если вы пользуетесь деминерализованной водой или при ухудшении состояния рыб, может быть, стоит добавить микроэлементы.
Химический состав воды
Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы - это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) - 300 г, почти треть от массы раствора.
химический состав вода
Основные (преобладающие) компоненты
В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO 3 - , хлорид Cl - исульфат SO 4 2- ) и четыре катиона (кальций Ca 2+ , магний Mg 2+ , натрий Na + и калий K + ) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br - , B 3+ , Sr 3+ и др. Отнесение ионов K + к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K + могут играть главную роль.
Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т.е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO 3 + , CaHCO 3 + .
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды).
Атмосферные осадки из всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO 4 2- или HCO 3 - , а среди катионов в зависимости от степени удаленности от побережья Ca 2+ или Na + . Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl - падает, а SO 4 2- , Ca 2+ и Mg 2+ , наоборот, повышается. Причиной повышения содержания SO 4 2- и Ca 2+ является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO 4 2- . Если увеличение содержания Ca 2+ и Na + связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO 4 2- обусловлено, с одной стороны, окислением SO 2 и H 2 S, с другой - поднятием сернокислых солей с засоленных поверхностей.
Не поддаются даже приблизительной оценке громадные количества солевых частиц, поднимаемых с почв, соленых озер, поверхности льда, удобрений и, наконец, выбрасываемых химическими и металлургическими производствами, и выбрасываемые в атмосферу в результате другой деятельность людей, а в дальнейшем вымываемые осадками.
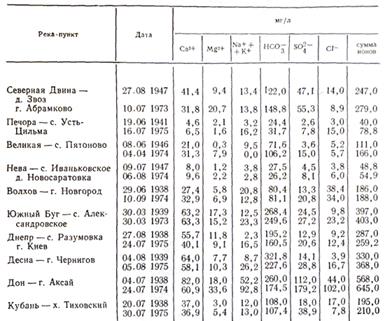
Воды большинства рек принадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия - крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л).
Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны. Они распространены преимущественно в степной полосе и частично в полупустынях. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды.
Реки, воды которых относятся к хлоридному классу, встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. К этой территории относятся преимущественно степные районы и полупустыни. Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией - свыше 1000 мг/л, реже от 500 до 1000 мг/л.
Приведенная характеристика ионного состава речной воды относится к периоду летней межени. До некоторой степени она характеризует состав и в период ледостава. Существенно иная, значительно меньшая минерализация воды наблюдается в период весеннего половодья.
В распределении ионного состава речной воды на территории России наблюдается определенная закономерность. Имеется общая тенденция к увеличению минерализации воды на большей территории европейской части России с севера на юг и с запада на восток. Зональность ионного состава речных вод объясняется не только действием климатических условий настоящего времени, но и в значительной мере климатом прошлого. Степень выщелоченности почв и пород, наличие в них легкорастворимых солей или засоленность почв - это естественный результат многовекового воздействия соответствующих климатических условий. Нарушают зональность химического состава воды рек на территории России различия состава пород и условий их залегания.
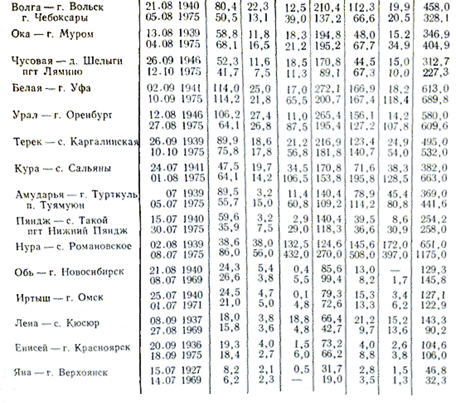
Минерализация и химический состав воды озер в отличие от рек меняется в очень широких пределах. Реки с минерализацией воды свыше 100-200 мг/л, в каких бы условиях они ни находились, - очень редкое явление, в то время как минерализация воды озер бывает от очень низкой, в несколько десятков мг/л (т.е. мало отличающейся от дождевом) до очень высокой 3-3,5% (соляные озера с рассолом до предела насыщенного солями). Различие в минерализации отражается и на ионном составе воды озер. В нем наблюдаются закономерности, которые свойственны и химическому составу речной воды. С увеличением минерализации озерной воды происходит относительный рост ионов в ее составе в такой последовательности: HCO 3 - >SO 4 2- >Cl - ; Ca 2+ >Mg 2+ >Na + . При минерализации до 500-1000 мг/л в составе озерной воды преобладают гидрокарбонатные ионы, свыше 0,1% - чаще всего сульфатные, а по достижении 0,3-0,5% в зависимости от литологических особенностей водосборной площади - сульфатные или хлоридные воды. В составе катионов озерных вод преобладающая роль кальция сохраняется лишь до 0,1-0,2%. При дальнейшем росте минерализации эту роль начинают играть ионы натрия. Ионы магния, так же как и во всех других водах, сохраняют при всех минерализациях промежуточное положение. Причина подобного распределения ионного состава заключается в различной растворимости солей. Подавляющая часть пресных озер, так же как и рек, по составу вод гидрокарбонатно-кальциевые.
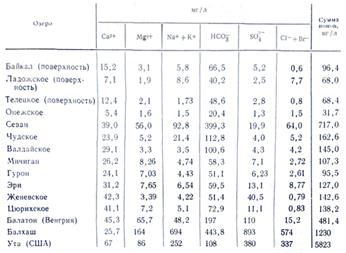
Состав морской воды характеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO 3 - > SO 4 2- > Cl - и Ca 2+ > Mg 2+ > Na + или Ca 2+ > Na + > Mg 2+ , то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl - > SO 4 2- > HCO 3 - и Na + > Mg 2+ > Ca 2+ . Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ.
Между элементами основного солевого состава океанской воды, между каждым из них и их суммой существует практическое постоянство соотношений концентраций. Окончательно его доказал У. Дитмар, выполнивший полный химический анализ (хлориды, сульфаты, кальций, магний, натрий) 77 проб воды, доставленных из всех океанов с различных глубин экспедицией на "Челленджере": в воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного солевого состава всегда постоянны (закон Дитмара). Под влиянием испарения, атмосферных осадков, образования и таяния льдов изменяется лишь общее количество солей, содержащихся в морской воде, но их соотношения в пределах погрешностей определений практически не меняются. Таким образом, если известно точное отношение общего количества солей и концентраций всех основных компонентов в 1 кг воды к концентрации какого-либо одного ингредиента, то лишь по одному определению можно вычислить полный солевой состав океанской воды. В качестве такого "реперного" ингредиента избрана "хлорность", представляющая собой количество граммов ионов хлора, эквивалентное сумме галогенов (кроме фторидов, которые не осаждаются азотнокислым серебром), содержащихся в 1 кг морской воды (определение Серенсена). Постоянство состава океанской воды слегка нарушается под опресняющим влиянием материкового стока в приустьевых участках и во внутренних морях при затрудненном водообмене с океаном. В составе главных компонентов концентрации катионов кальция и магния, а также сумма концентраций анионов слабых кислот (HCO 3 - , CO 3 2- , H 2 BO 3 -) подвержены более чем на 1 % отклонениям от постоянства соотношении в связи с извлечением карбоната кальция из воды в поверхностных слоях и растворением его на глубинах.
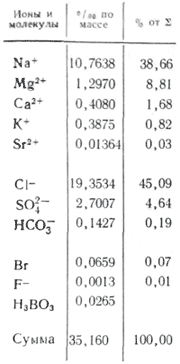
Концентрации микроэлементов настолько малы, что в сумме они не превышают 0,01 % массы всех растворенных солей. Из обобщающей сводки В.В. Гордеева и А.П. Лисицына следует, что в наибольших концентрациях встречаются литий (180 мкг/л), рубидий (120 мкг/л), барий (18 мкг/л), в наименьших - золото (0,004 мкг/л), редкоземельные элементы (менее 0,001 мкг/л), радий (10 -7 мкг/л).
Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные воды отличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания.
Особенность химического состава природных вод. Внутренняя структура молекул воды. Физические свойства воды.
ВЫПОЛНИЛА: ЕРГЕШБАЕВА С.Б. ПРОВЕРИЛА: ЖУМАБАЕВА Ж.Е.
АСТАНА-2011г.
Химический состав воды
Структура молекулы воды
Физические свойства воды
Список использованной литературы
Химический состав воды
Введение
Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы - это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) - 300 г, почти треть от массы раствора.
Основные (преобладающие) компоненты
В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO 3 - , хлорид Cl - и сульфат SO 4 2-) и четыре катиона (кальций Ca 2+ , магний Mg 2+ , натрий Na + и калий K +) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br - , B 3+ , Sr 3+ и др. Отнесение ионов K + к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K + могут играть главную роль.
Атмосферные осадки из всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO 4 2- или HCO 3 - , а среди катионов в зависимости от степени удаленности от побережья Ca 2+ или Na + . Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl - падает, а SO 4 2- , Ca 2+ и Mg 2+ , наоборот, повышается. Причиной повышения содержания SO 4 2- и Ca 2+ является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO 4 2- . Если увеличение содержания Ca 2+ и Na + связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO 4 2- обусловлено, с одной стороны, окислением SO 2 и H 2 S, с другой - поднятием сернокислых солей с засоленных поверхностей.
Состав морской воды характеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO 3 - > SO 4 2- > Cl - и Ca 2+ > Mg 2+ > Na + или Ca 2+ > Na + > Mg 2+ , то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl - > SO 4 2- > HCO 3 - и Na + > Mg 2+ > Ca 2+ . Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ.
Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные воды отличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания.
Органические вещества
Органическим веществом природных вод называют комплекс истинно растворенных и коллоидных веществ органических соединений. По происхождению органические вещества природных вод могут быть разделены на поступающие извне (с водосборной площади) и образующиеся в самом водном объекте. К первой группе относятся главным образом гумусовые вещества, вымываемые водой из почв, торфяников, лесного перегноя и других видов природных образований, включающих остатки растений, и органические вещества, поступающие с промышленными и хозяйственно-бытовыми сточными водами. Из гумусовых веществ для гидрохимии наибольший интерес представляют гуминовые и фульвокислоты. Обе эти кислоты характерны для гумуса (гумусовые кислоты), они не содержатся в живых растительных и животных тканях. Соотношение между ними в разных торфах и почвах неодинаково. В черноземных почвах преобладают гуминовые, а в подзолистых - фульвокислогы.
Газы в природной воде
Если налить в стакан холодную воду из-под крана и поставить в тёплое место, на стенках появятся пузырьки газа. Газы были растворены в холодной воде и выделились при нагревании (поскольку растворимость газов при нагревании уменьшается). Это кислород, азот и углекислый газ. Растворимость газа в воде обычно падает с повышением температуры, что связано с повышением кинетической энергии молекул газа, способствующей преодолению сил притяжения молекул воды. Все природные воды представляют газовые растворы. Наиболее широко распространены в поверхностных водах кислород O 2 и двуокись углерода CO 2 , а в подземных - сероводород H 2 S и метан CH 4 . Иногда CO 2 в значительных количествах может насыщать также воды глубоких горизонтов. Кроме того, во всех природных водах постоянно присутствует азот N 2 .
Кислород (O 2) находится в природной воде в виде растворенных молекул. Кислород, являясь мощным окислителем, играет особую роль в формировании химического состава природных вод. Кислород поступает в воду в результате происходящих в природе процессов фотосинтфотосинтеза и из атмосферы. Расходуется кислород на окисление органических веществ, а также в процессе дыхания организмов. Концентрация растворенного кислорода в природных водах колеблется в ограниченных пределах (от 0 до 14 мг/л, при интенсивном фотосинтезе, в полдень, возможна и более высокая концентрация). Вследствие зависимости концентрации кислорода в поверхностных водах от целого ряда факторов его концентрация значительно меняется в течение суток, сезона и года. Так как потребление кислорода сравнительно мало зависит от суточных изменений солнечной радиации, а фотосинтез всецело определяется ею, то в течение дня происходит накопление кислорода, а в темное время суток расходование его. Кислород необходим для существования большинства организмов, населяющих водоемы. Как сильный окислитель кислород играет важную санитарно-гигиеническую роль, способствуя быстрой минерализации органических остатков.
Диоксид углерода (CO 2) находится в воде главным образом в виде растворенных молекул газа CO 2 . Однако часть их (около 1 %) вступает во взаимодействие с водой, образуя угольную кислоту:
CO 2 + H 2 O ↔ H 2 CO 3
Обычно же не разделяют CO 2 и H 2 CO 3 и под диоксидом углерода подразумевают их сумму (CO 2 + H 2 CO 3). В природных водах источником диоксида углерода являются прежде всего процессы окисления органических веществ, происходящие с выделением CO 2 как непосредственно в воде, так и в почвах и илах, с которыми соприкасается вода. К ним относятся дыхание водных организмов и различные виды биохимического распада и окисления органических остатков. В некоторых подземных водах важным источником диоксида углерода являются вулканические газы, выделяющие из недр земли, происхождение которых связано с дегазацией мантии и со сложными процессами метаморфизации осадочных пород, протекающими в глубинах под влиянием высокой температуры. Поэтому часто в подземных водах и источниках глубинного происхождения наблюдается высокое содержание диоксида углерода. Поглощение водой диоксида углерода из атмосферы имеет более важное значение для воды морей и океана и менее значимо для вод суши. Уменьшение содержания диоксида углерода прежде всего происходит при фотосинтезе. При очень интенсивном фотосинтезе, когда отмечается полное потребление газообразного CO 2 , последний может быть выделен из ионов HCO 3 - :
HCO 3 - ↔ CO 3 2- + CO 2
Диоксид углерода расходуется также на растворение карбонатов:
CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2
Также расходуется на химическое выветривание алюмосиликатов. Уменьшение содержания CO 2 в воде, особенно в поверхностных водах суши, происходит также при выделении его в атмосферу. Вообще CO 2 атмосферы имеет большое значение для CO 2 содержащегося в поверхностных водах, регулируя его содержание там. Между CO 2 атмосферы и CO 2 поверхностных вод существует непрерывный обмен, направленный на установление между ними равновесия, согласно закону Генри-Дальтона. Поскольку парциальное давление диоксида углерода в атмосфере очень невелико (33 Па), то, несмотря на большую растворимость его (при давлении 1013 гПа и температуре 12 °С до 2166 мг/л), равновесие между водой и атмосферой достигается при очень малом содержании CO 2 в воде. При парциальном давлении CO 2 в атмосфере 33 Па растворимость его в воде будет 2166 0,00033=0,715 мг/л (при 12 °С). Обычно же поверхностные воды суши, в которых протекают различные процессы разложения органического вещества и которые связаны с почвами, имеют большее содержание CO 2 и поэтому выделяют его в атмосферу. Лишь при очень сильном фотосинтезе, когда CO 2 практически исчезает, может происходить поглощение CO 2 из атмосферы. Содержание диоксида углерода в природных водах чрезвычайно разнообразно - от нескольких десятых долей до 3000-4000 мг/л. Наименьшая концентрация CO 2 наблюдается в поверхностных водах, особенно минерализованных (моря, соленые озера), наибольшая - в подземных и загрязненных сточных водах. В реках и озерах концентрация CO 2 редко превышает 20-30 мг/л.
Растворенный молекулярный азот (N 2) - наиболее постоянный газ в природных водах. В высшей степени химически устойчивый и биологически трудно усвояемый, азот, будучи занесен в глубинные слои океана или подземные воды, меняется главным образом лишь под влиянием физических условий (температура и давление). Растворенный в поверхностных водах азот имеет преимущественно воздушное происхождение. Наряду с этим в природе широко распространен азот биогенного происхождения, возникающий в результате денитрификации.
Газ метан (CH4) относится к числу наиболее распространенных газов и подземных водах. В газовой фазе подземных вод почти всегда количественно преобладает азот, двуокись углерода или метан. Основным источником образования метана служат дисперсные органические вещества в породах. Метан и тяжелые углеводороды, нередко встречаются в значительных концентрациях в глубинных подземных водах закрытых структур, связанных с нефтеносными месторождениями. В небольшой концентрации метан наблюдается в природных слоях озер, где он выделяется из ила при разложении растительных остатков, а также в океанических донных отложениях в районах высокой биологической продуктивности.
Газ сероводород (H 2 S) является одним из продуктов распада белкового вещества, содержащего в своем составе серу, и поэтому скопление его часто наблюдается в придонных слоях водоемов вследствие гниения различных органических остатков. В нижних частях глубоких озер и морей, где отсутствует водообмен, часто образуется сероводородная зона. При парциальном давлении сероводорода в атмосфере, равном нулю, длительное присутствие его в поверхностных водах невозможно. Кроме того, он окисляется кислородом, растворенным в воде. В реках сероводород наблюдается лишь в придонных слоях, главным образом в зимний период, когда затруднена аэрация водной толщи. Присутствие сероводорода в природных незагрязненных поверхностных водах - сравнительно редкое явление. Гораздо чаще сероводород присутствует в подземных водах, изолированных от поверхности и в сильно загрязненных поверхностных водах, в которых он служит показателем сильного загрязнения и анаэробных условии.
Мезоэлементы
Кроме главных ионов, содержание которых в воде достаточно велико, ряд элементов: азот, фосфор, кремний, алюминий, железо, фтор - присутствуют в ней в концентрациях от 0,1 до 10 мг/л. Они называются мезоэлементами (от греч. "мезос" - "средний", "промежуточный").
Азот в форме нитратов NO 3 - попадает в водоёмы с дождевой водой, а в форме аминокислот, мочевины (NH 2) 2 CO и солей аммония NH 4 + - при разложении органических остатков.
Фосфор существует в воде в форме гидрофосфатов HPO 3 2- и дигидрофосфатов H 2 PO 3 - , образующихся в результате разложения органических остатков.
Кремний является постоянным компонентом химического состава природных вод. Этому способствует в отличие от других компонентов повсеместная распространенность соединений кремния в горных породах, и только малая растворимость последних объясняет малое содержание кремния в воде. Концентрация кремния в природных водах обычно составляет несколько миллиграммов в 1 л. В подземных водах она повышается и часто достигает десятков миллиграммов в 1 л, а в горячих термальных водах - даже сотен. На растворимость кремния, кроме температуры сильно влияет повышение pH раствора. Сравнительно малое содержание кремния в поверхностных водах, уступающее растворимости диоксида кремния (125 мг/л при 26 °С, 170 мг/л при 38 °С), указывает на наличие в воде процессов уменьшающих ее концентрацию. К ним надо отнести потребление кремния водными организмами, многие из которых, например диатомовые водоросли, строят свой скелет из кремния. Кроме того, кремниевая кислота как более слабая вытесняется из раствора угольной кислотой:
Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4NaHCO 3
Способствует неустойчивости кремния в растворе и склонность кремниевой кислоты при определенных условиях переходить в гель. В очень мало минерализованных водах кремний составляет существенную, а иногда и преобладающую часть химического состава воды, несмотря на его малое абсолютное содержание. Присутствие кремния в воде является серьезной помехой в технике, так как при продолжительном кипячении воды кремний образует в котлах очень твердую силикатную накипь.
Алюминий поступает в водоёмы в результате действия кислот на глины (каолин):
Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+
Основной источник железа - железосодержащие глины. Органические остатки (ниже обозначаются как "С"), находящиеся в контакте с ними, восстанавливают железо до двухвалентного, которое медленно вымывается в форме гидрокарбоната или солей гуминовых кислот:
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2
Когда вода с растворёнными в ней ионами Fe 2+ вступает в контакт с воздухом, железо быстро окисляется, образуя коричневый осадок гидроксида Fe(OH) 3 . Со временем он превращается в болотную руду - бурый железняк (лимонит) FeO(OH). Карельская болотная руда использовалась в XVIII-XIX столетиях для получения железа.
Синеватая плёнка на поверхности воды - это Fe(OH) 3 , образующийся, когда подземные воды, содержавшие ионы Fe 2+ , вступают в контакт с воздухом. Ее часто путают с масляной пленкой, однако различить их очень легко: у пленки гидроксида железа рваные края. Если поверхность воды слегка взволновать, гидроксидная пленка, в отличие от масляной, не будет переливаться.
Микроэлементы
К этой группе относятся элементы, соединения которых встречаются в природных водах в очень малых концентрациях, поэтому их и называют микроэлементами. Их концентрация измеряется микрограммами в 1 л (мкг/л), а часто имеет и более малые значения. Микроэлементы представляют собой самую большую группу элементов химического состава природных вод, в нее входят все элементы периодической системы, не включенные в предыдущие группы рассмотренных компонентов. Условно их можно разделить на пять подгрупп: 1) типичные катионы (Li + , Rb + , Cs + , Be 2+ , Sr 2+ , Ba 2+ и др.); 2) ионы тяжелых металлов (Cu 2+ , Ag + , Au + , Pb 2+ , Fe 2+ , Ni 2+ , Co 2+ и др); 3) амфотерные комплексообразователи (Cr, Mo, V, Mn); 4) типичные анионы (Br - , I - , F -); 5) радиоактивные элементы. Микроэлементы необходимы для нормальной жизнедеятельности растений, животных и человека. Однако при повышенной концентрации многие микроэлементы вредны и даже ядовиты для живых организмов. Поэтому часто они становятся загрязняющими веществами и концентрация их контролируется. Успешное изучение микроэлементов затруднено не только их малым содержанием в природных водах, но и в сильнейшей мере неясностью формы их присутствия в растворе. Последнее не только осложняет выяснение закономерностей их миграции и режима но и создает трудности при химическом анализе. Например, многие тяжелые металлы мигрируют в больших концентрациях именно во взвешенном, а не в растворенном состоянии. Растворенные органические комплексы образуют большинство металлов, прежде всего двух- и трехвалентные металлы с гуминовыми и фульвокислотами. Концентрация закомплексованных металлов определяется прежде всего концентрацией органических кислот. В виде коллоидных соединений присутствуют многие гидроксиды металлов. Возможно, происходит адсорбция органических веществ на поверхности коллоидов, что придает им большую стабильность в растворе.
Структура жидкости
Применение термина "структура" для описания льда понятно, лед кристалл и, разумеется, обладает внутренней структурой. Но что такое структура жидкости? "Разве отсутствие структуры - текучесть - не является определяющим качеством жидкости?" - писал Бернал. Оказывается, жидкость обладает структурой, и не одной, а несколькими. Все дело во временном масштабе.
Если с какой-либо фиксированной молекулой воды связать систему координат, то для наблюдателя, находящегося в этой системе, структура воды будет зависеть от характерного масштаба времени, с которым он будет наблюдать молекулярную жизнь воды. У воды существуют два характерных временных параметра. Как и у всякого вещества, будь то жидкость или твердое тело, существует период колебаний отдельной молекулы τ υ . Для воды эта величина составляет значение 10 -13 с. В жидкости, кроме периода колебаний молекул около своего положения равновесия τ υ , имеется еще одно характерное время - время "оседлой жизни" τ D , т.е. среднее время существования данного локального окружения одной молекулы. Для воды τ D ~ 10 -11 с, т.е. прежде чем перескочить на новое место, молекула воды совершает 100 колебаний на одном месте.
Два эти параметра разбивают временную шкалу на три области, каждой из которых соответствует своя структура жидкости. Если наблюдатель будет пользоваться достаточно малым временным масштабом, т.е. будет смотреть в течение времени, много меньшего τ υ , то он увидит хаотически разбросанные молекулы, среди которых трудно усмотреть какой-либо порядок. Тем не менее это беспорядочное расположение молекул называют мгновенной, или М-структурой.
Чтобы понять, почему все-таки этот беспорядок называют структурой, наблюдателю необходимо перейти к более длительному временному масштабу. Но не слишком, точнее, больше чем τ υ , но меньше чем τ D . На этом временном интервале реальные молекулы уже не будут видны, наблюдатель сможет увидеть лишь точки, вокруг которых они совершают свои колебания. Оказывается, что эти точки в воде расположены довольно регулярно и образуют четкую структуру, называемую К-структурой, что означает "колебательно усредненная".
М- и К-структуры воды подобны таким же структурам льда. Чтобы увидеть различия этих структур у воды и льда, нужно понаблюдать за ними несколько дольше, т.е. с характерным временем, много большим чем τ D . Наблюдаемую в этом случае картину называют Д-структурой - диффузионно усредненной. В отличие от льда Д-структура воды полностью размыта из-за частых перескоков молекул воды на большие расстояния (эти перескоки составляют процесс самодиффузии молекул воды). Д-структура образуется диффузионным усреднением К-структур и не может быть описана каким-либо особым расположением точек в пространстве. Сторонний наблюдатель видит, что, по сути дела, никакой Д-структуры жидкости и не существует (заметим, что именно Д-структура как полное статистическое усреднение ансамбля молекул определяет термодинамические свойства воды.).
И тем не менее Д-структура существует, и ее можно увидеть. Наблюдатель, находящийся на некоторой молекуле воды, увидит, что его собственная молекула, перемещается хаотически по всему объему воды, каждый раз оказывается в более или менее упорядоченном окружении. Он увидит, что чаще всего "его" молекулу будут окружать четыре других молекулы H 2 O, иногда соседей окажется пять, иногда шесть, в среднем как мы знаем, их будет 4,4. Таким образом, Д-структурой воды можно считать картину, видимую наблюдателем.
Такой подход к описанию структуры воды чаще всего используется при интерпретации спектроскопических данных, потому что различные спектроскопические методы - рентгеновский, ЯМР, диэлектрическая релаксация, комбинационное рассеяние нейтронов - способны "считывать" молекулярные данные с различным характерным временем разрешения.
Перемещение молекул доказывается обычно броуновским движением. Каплю воды, в которой плавают очень легкие частицы твердого нерастворимого вещества, рассматривают под микроскопом и наблюдают, что частицы беспорядочно перемещаются в массе воды. Каждая такая частица состоит из множества молекул и не облачает самопроизвольным движением. Частицы испытывают удары со стороны движущихся молекул воды, которые заставляют их всё время менять направление движения, а это означает, что сами молекулы воды движутся беспорядочно.
Физические свойства
Вода обладает рядом необычных особенностей:
При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг ), по сравнению с соединениями водорода с похожим молекулярным весом.
Высокая теплоёмкость жидкой воды.
Низкая вязкость.
Высокое поверхностное натяжение.
Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Определенную роль играет протонное обменное взаимодействие между молекулами и внутри молекул воды. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода - каждый в одной, а атом кислорода - в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °C этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Капля, ударяющаяся о поверхность воды
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные - атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода - хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода - хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.






