Cтраница 1
Устранение временной жесткости проводится кипячением воды. При кипячении гидрокарбонаты разрушаются, образующиеся малорастворимые карбонаты выпадают в осадок. При введении в воду карбоната натрия, гидроксида кальция удаляется общая жесткость воды. Карбонатная жесткость при этом устраняется известью, а некарбонатная - содой.
Наиболее распространенным является использование смягчителей воды, которые обменивают кальций и магний на натрий. Эта технология используется в жилых, коммерческих и промышленных условиях. В промышленных и муниципальных применениях смягчение извести можно использовать с осветлителями и добавлением извести. Кальций и магний осаждаются из воды и образуют осадок на дне осветлителя. В этой публикации в основном обсуждается, как работают умягчители воды из-за процесса ионного обмена.
Твердость воды измеряется в зернах на галлон и частично на миллион или миллиграмм на литр. Ниже приведена классификация жесткости воды. Вода может быть проверена с использованием наборов жесткости воды, таких как тест-полоски, титры и различные цифровые тестеры с ручным управлением. Как только твердость известна, можно вычислить емкость катионообменной смолы. Емкость определяется жесткостью воды, дозировкой соли и количеством используемой катионной смолы. Дозировка соли равна следующим объемам в зернах.
Кроме устранения временной жесткости, известь осаждает из воды весь магний, железо и способствует коагуляции органических и неорганических коллоидов.
После очистки примесей, устранения временной жесткости и деаэрации подпиточную воду подают в теплообменник (2), где она подогревается до 335 К. Подпиточную и обратную воду после смешения подают насосом во вторую зону теплообменника (2), где она подогревается до 355 К и поступает в тепловые сети.
Теперь, когда мы знаем, как рассчитываются твердость и дозировка соли, мы можем определить способность катионной смолы на кубический фут. Ниже приведены просто используемые уравнения. Предположим, что 10 фунтов. соли на кубический фут смолы вместе с 25 зернами на галлон твердости.
Причина, по которой эти расчеты становятся настоятельными в приложениях для смягчения воды, заключается в том, что она влияет на дизайн оборудования. Размер умягчителя воды определяется емкостью. Он также включает расчет расхода, но на данный момент размер и мощность связаны исключительно.
Умягчение часто применяется для устранения временной жесткости воды, предназначенной для восполнения потерь (подпитки) в замкнутых системах оборотного водоснабжения и недопущения минерального обрастания теплообменных и охлаждающих поверхностей, контактирующих с оборотной водой. Во многих случаях подпиточная вода является основным источником накопления в оборотной воде ионов кальция и биокарбонатов, которые в системах с высокими коэффициентами упаривания могут нарушать стабильный состав оборотной воды.
Имейте заданную емкость, о которой мы говорили выше. Как только эта мощность будет исчерпана, смягчитель воды должен регенерировать или смолу необходимо будет постоянно заменять. Поскольку это почти всегда неосуществимо, умягчители воды должны регенерировать с использованием соли.
Обратная промывка контролируется отверстием для контроля потока обратной промывки. Стандартная скорость обратной промывки должна составлять 5 галлонов в минуту на квадратный фут площади поверхности кровати. При обратной промывке слой смолы расширяется за счет обратного потока для удаления органического вещества и любых частиц, которые накапливаются на шариках смолы. Затем проводится рассол, который втягивает рассол в слой смолы в том же направлении, что и поток рабочей воды.
Умягчение воды с целью устранения временной жесткости проводится химическим способом путем ввода реагентов, в качестве которых применяются известь, серная или соляная кислоты. Химическими методами достигается относительно неглубокое умягчение воды. Для более высокой степени умягчения применяют катионитовые методы, сущность которых заключается в использовании способности некоторых веществ обменивать катионы содержащегося в них натрия на катионы солей жесткости, находящихся в воде.
Рассол поступает из ближайшего рассольного резервуара, соляного раствора или дневного резервуара солевого бункера. Во время рассола, катионные бусины перезаряжаются, чтобы привлечь кальций и магний к своей сердцевине, которую он обменивает с ионами натрия. Скорость вытяжки рассола регулируется с помощью трубки Вентури или рассольного насоса. В то время как рассол втягивается в слой смолы, пресная вода также используется для разбавления и помогает равномерно распределять рассол над полом. После завершения рассола, который контролируется с помощью проверки воздуха или по времени, начинается медленное полоскание.
Сода каустическая используется на тепловых электростанциях для устранения временной жесткости воды, для регенерации аниови-товых фильтров, применяемых на установках химического обессоли-вания воды.
Сода каустическая используется на тепловых электростанциях для устранения временной жесткости воды, для регенерации аниони-товнх фильтров, применяемых на установках химического обес поливания воды.
При медленном полоскании пресная вода используется для полоскания примерно 80% рассола из постели. При быстром промывании скорость потока такая же, как и обратная промывка, но находится в том же направлении, что и сервис, который упаковывает кровать обратно в рабочее положение, а также промывает оставшиеся 20% рассола. Поскольку весь рассол был удален из резервуара для рассола, его необходимо пополнить. Чтобы пополнить его, свежую воду отправляют обратно через тот же трубопровод, что и в результате рассола.
Расчет сделать по формуле
Заправка регулируется с помощью контроля потока рассольной линии и запрограммирована на пополнение времени. В зависимости от применения, умягчители воды разработаны несколькими способами. Для жилых и коммерческих применений наиболее распространенной конструкцией является сосуд высокого давления из стекловолокна с установленным сверху клапаном. Это, как правило, самый экономичный дизайн для затрат на оборудование и установку. Основное ограничение для этой конструкции заключается в том, что она не способна обрабатывать высокие скорости потока.
Аналогичным образом следует рассчитывать также и количество Са (ОН) 2, необходимое для устранения временной жесткости.
Почему для устранения временной жесткости, обусловленной солями магния, требуется большее количество извести, чем для устранения временной жесткости, обусловленной солями кальция.
Поэтому для подпитки замкнутых (беспродувочных) систем водоснабжения следует осуществлять сравнительно глубокое умягчение подпиточной воды и устранение временной жесткости.
Способы устранения жесткости
Для более высоких скоростей потока наиболее распространенной конструкцией является гнездо клапана со стальными сосудами под давлением. Вместо использования верхнего установленного клапана вместо этого используются шесть клапанов. Эта конструкция позволяет уменьшить потери давления и используется в коммерческих и промышленных целях. Клапанные гнезда гораздо более прочные и имеют меньше механических отказов по сравнению с верхними установленными клапанами, когда они используются на постоянной основе.
Введение небольших количеств щелочных реагентов повышает эффективность магнитной обработки воды, хотя само по себе введение щелочных реагентов, например, извести в количествах не более 10 - - 20 % от необходимых для устранения временной жесткости согласно исследованиям, выполненным в ХИЭИ в 1959 г., уменьшает накипеобразование в 8 - 10 раз.
Повреждение, которое может иметь жесткая вода, означает, что может быть полезно смягчить воду. Существует два метода размягчения жесткой воды. Добавление карбоната натрия к воде с использованием ионообменных колонок. . Он может удалить временную и постоянную твердость из воды. Карбонат натрия является растворимым, но карбонат кальция и карбонат магния нерастворимы.
Ионы кальция карбонат натрия → ионы натрия карбоната кальция. Вода размягчается, потому что она больше не содержит растворенных ионов кальция и ионов магния. Он будет легче пропитывать мылом. Также, будучи неприглядным на ваших кранах, он также может забивать трубы в системах отопления.
При этом шест-кость воды, обусловленная бикарбонатами, устраняется. Поэтому такая жесткость называется временной, или бикарбонатной. Следовательно, для устранения временной жесткости достаточно прокипятить воду.
Соли постоянной жесткости, например СаСЬ, CaSO4 и др., при нагревании из воды не удаляются. Они выделяются в осадок при испарении воды, образуя на стенках аппаратов трудно удаляемую плотную накипь. Жесткую воду можно использовать только в тех случаях, когда условия ее применения не вызывают выделения твердых осадков, например в холодильниках, где охлаждающая вода не нагревается до температуры, способствующей устранению временной жесткости. В котельных установках, где вода не только нагревается, но и испаряется, недопустима не только временная, но и постоянная жесткость. Поэтому воду для них предварительно очищают от солей кальция и магния химическим способом на специальных установках.
Это делает обработку карбоната натрия подходящей для смягчения воды только при определенных обстоятельствах - например, для смягчения воды для мытья рук. Коммерческие умягчители воды часто используют ионообменную смолу: «Сырой» пластик, особенно в полужидкой форме. Вещества, которые наносят на поверхность ткани, испаряются, оставляя на ней пленку. Эти вещества обычно изготавливают в виде шариков, которые упаковываются в цилиндры, называемые ионообменными колоннами, которые могут быть встроены в машины, такие как посудомоечные машины, или отводятся в водоемы для непрерывного размягчения воды.
Высокая жесткость воды в системах отопления и ГВС негативно влияет на процессы теплообмена, увеличивая энергозатраты. Кроме того, жесткая питьевая вода вредна для здоровья человека. Для воды различного назначения используются различные методы умягчения.
Умягчение воды - это процесс удаления из воды солей жесткости. Но что такое жесткость воды и почему её необходимо удалять?
И способов ее устранения
Смоляные шарики снабжены к ним ионами натрия. Когда твердая вода проходит через колонку, ионы кальция и магния меняются местами с ионами натрия. Ионы кальция и магния остаются прикрепленными к шарикам, а вода, выходящая из колонки, содержит больше ионов натрия. Твердая вода размягчается, поскольку она больше не содержит ионов кальция или магния. Некоторые ионообменные смолы вместо ионов натрия используют ионы водорода.
Ионы натрия, которые он содержит, заменяют ионы кальция и магния на шариках. Хлорид натрия дешев и широко доступен, что делает его удобной и экономичной системой. Твердость воды представляет собой выражение содержания ионов щелочноземельных металлов в минерально-содержащей пружине, питьевой воде или водопроводной воде.
Понятие жесткости воды принято связывать с катионами кальция (Са 2+) и, в меньшей степени, магния (Mg 2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок.
В осадок могут выпадать и соли железа, марганца, стронция, но на практике все эти элементы оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают.
Общая твердость воды характеризует сумму ионов концентрата растворенных солей щелочноземельных металлов, которые в основном представляют собой катионы кальция и магния с ассоциированными анионами. Общая жесткость воды состоит из двух форм: временная жесткость вызвана бикарбонатами.
Постоянная твердость воды основана на солях с другими анионами. Термины твердые и мягкие являются следствием ощущения, которое дает особая вода при мытье мылом. В качестве щелочных солей слабых жирных кислот мыло легко гидролизуется с образованием щелочных щелоков, которые делают воду мягкой, в то время как в жесткой воде жирные кислоты осаждаются в виде малорастворимых известковых почв без образования щелочных щелоков.
Алюминий (Al 3+) и трехвалентное железо (Fe 3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва 2+).
Виды жесткости
Различают несколько видов жесткости воды. Общая жесткость определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Водопроводная вода была классифицирована местными водоводами в районах мягких, средних, жестких и жестких. На международном уровне классификация по концентрации ионов щелочноземельных металлов в миллимолях на литр. Это видео называется «жесткость воды». Предыдущие знания должны помочь вам ознакомиться с химическими терминами оснований, кислот, солей, нейтрализации и диссоциации. Чтобы вы были проинформированы о преимуществах и недостатках жесткой воды. Фильм состоит из 7 разделов. Благодарю за внимание.
Умягчение воды и сводная информация. Вода не имеет полос. Что-то вроде этого обычно говорят - или так показано здесь. В результате вода не является твердой. Но как это понимать? Просто и все же так сложно. Твердая вода содержит ионы кальция и ионы магния. Происхождение жесткости воды Существуют различные минералы в природе, содержащие ионы кальция и магния. Важными представителями являются кальцит и арагонит. Минеральный доломит можно рассматривать как смесь карбоната кальция и карбоната магния. Так называемые ороиды кристаллизуются из природных водных ресурсов. Они содержат кальций и магний. Кроме того, в сталактитах пещер мы находим ионы кальция и магния. Ионы кальция и магния вымываются из минералов водой и затем достигают соответствующих проявлений. Мягкая и твердая вода Мягкая - до сих пор твердая вода помещается в шкале от 0 до более 30. В первой трети мы находимся очень мягкими и мягкими. От 10 до 15 - средний. Трудно бывает около 20, а затем следует очень жесткая вода. Общая твердость состоит из двух компонентов. Это временная твердость, также называемая карбонатной твердостью. Часть - постоянная твердость; их также называют сульфатной твердостью. Временную твердость можно устранить добавлением или нагреванием кислоты. Твердость может быть определена с помощью откалиброванного мыльного раствора. Преимущества жесткой воды Вы слышите так много зла о жесткой воде. Итак, давайте начнем с преимуществ. Ионы кальция и магния жизненно важны. Ионы магния служат для формирования плазмы крови. Многие ферментные реакции происходят с участием ионов магния. Ионы кальция необходимы для мышечной активности. Функция нервов без них невозможна. Кроме того, ионы кальция необходимы для деления клеток и свертывания крови вне тела. Жесткая вода нейтрализует агрессивную углекислоту. Жесткая вода образует слой на металлических поверхностях, что препятствует коррозии. Кроме того, жесткая вода вызывает буферный эффект в почве. Почва не становится кислой из-за ограниченной кислотности. Недостатки жесткой воды Уже давно известно, что жесткая вода образует масштаб. Растворимый бикарбонат кальция образуется из нерастворимого в воде карбоната кальция - это масштаб. Он может содержаться в дополнение к карбонату кальция и карбонатом магния. Побочными продуктами, образующимися во время реакции, являются вода и двуокись углерода. Карбонат кальция является плохим проводником тепла. В результате увеличивается потребление энергии, местный перегрев и разрушение котла. Масштабирование ведет в водопроводных трубах к поперечному сужению. Другие недостатки имеют жесткая вода. Чай и кофе подвергаются уменьшению вкуса при их приготовлении, и, наконец, например, это может привести к появлению пятен на стеклянной посуде. Реакция с мылом также нежелательна, потому что твердая вода образует мыло с мылом. Известь мыла нерастворима в воде, она не моется активной. Известь мыла образует серое покрытие. Из-за известкового мыла это нападает на структуру волокна, поэтому белье было настолько тяжелым. Сегодня мыло больше не используется. Умягчение воды Перед умягчением воды определение твердости часто имеет смысл. С кислотой, такой как соляная кислота, вы можете определить карбонатную твердость. Ион бикарбоната реагирует с ионом гидриона с образованием молекулы двуокиси углерода и 2 молекулы воды. Одним из способов смягчения воды является осаждение. Растворимый бикарбонат кальция реагирует с гидроксидом кальция. Карбонат кальция осаждается и образуется вода. Другая возможность - это растворение. Растворимый гидрокарбонат кальция реагирует с соляной кислотой. Он образует растворимый хлорид кальция, образуется вода и выделяется углекислый газ. Как определить карбонатную жесткость. Метод представляет собой сложное образование, которое мы уже обсуждали во время анализа. Ионы кальция и магния удаляют из раствора. Такой же эффект достигается с помощью ионообменника. Абстрактная твердая вода содержит жизненно важные ионы. Слишком большая твердость имеет негативные последствия. При подходящих методах смягчения воды можно противодействовать этому.
- Вода не имеет стержней.
- Происхождение жесткости воды.
- Мягкая и твердая вода.
- Преимущества жесткой воды.
- Недостатки жесткой воды.
Карбонатная жесткость обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8,3). Временная жесткость характеризуется присутствием в воде наряду с катионами Ca 2+ , Mg 2+ и Fe 2+ гидрокарбонатных, или бикарбонатных анионов (HCO 3-). Данный тип жесткости почти полностью устраняется при кипячении воды и именно поэтому получил название временной жесткости. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция, гидроксида магния и железа.
Некарбонатная жесткость обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется, поэтому получила наименование постоянной жесткости.
Единицы измерения
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом.
За единицу жесткости принимают жесткость воды, в 1 л которой содержится 1 ммоль эквивалентов Ca 2+ или Mg 2+ . Одна единица жесткости (1 ммоль/л) соответствует содержанию ионов кальция, равному 20,04 мг/л или ионов магния, равному 12,15 мг/л. Общую жесткость воды (H) можно вычислить по формуле:
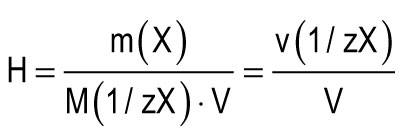
m(X) - масса растворенного вещества, мг; M(1/zX) - молярная масса эквивалента вещества, мг/ммоль (г/моль); V - объем воды, л; M(1/zCa 2+) = 20,04 мг/ммоль; M(1/zMg 2+) = 12,15 мг/ммоль.
Кроме этого в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (˚d, dH), французский градус (˚f), американский градус, ppm CaCO 3 .
Соотношение этих единиц жесткости представлено в табл. 1.
Таблица 1. Соотношение различных единиц жесткости
Так, один немецкий градус соответствует 10 мг/дм 3 СаО или 17,86 мг/дм 3 СаСО 3 в воде. Один французский градус - 10 мг/дм 3 СаСО 3 в воде, а американский градус эквивалентен 1 мг/дм 3 СаСО 3 в воде.
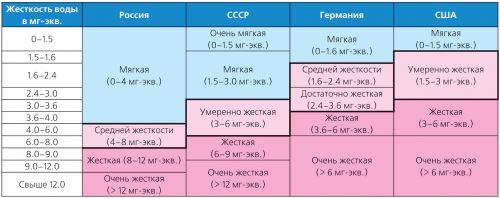
Жесткость воды колеблется в широких пределах и существует множество типов ее классификаций. Так, в Германии применяются нормы жесткости Немецкого института стандартизации (DIN 19643), а в США - классификация, принятая Агентством по охране окружающей среды (USEPA) в 1986 г. (табл. 2).
Таблица 2. Классификация различных типов жесткости
Какая вода мягче
Обычно в маломинерализованных водах преобладает жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени общей минерализации воды содержание ионов кальция (Са 2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg 2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океаническая вода имеют очень высокую жесткость (десятки и сотни мг-экв/л).
Последствия жесткости
Жесткая питьевая вода горьковата из-за магния на вкус и оказывает отрицательное влияние на органы пищеварения. По нормам Всемирной организации здравоохранения (ВОЗ), оптимальная жесткость питьевой воды составляет 1,0-2,0 мг-экв/л.
В жесткой воде плохо развариваются продукты питания, так как катионы кальция с белками пищи образуют нерастворимые соединения; их питательная ценность уменьшается. Постоянное употребление жесткой воды может привести к отложению солей (мочекаменная болезнь) в организме человека.
В такой воде плохо завариваются чай, кофе. В бытовых условиях избыток солей жесткости приводит к зарастанию накипью нагревающихся поверхностей в бойлерах, чайниках, трубах, отложению солей на сантехарматуре и выводу ее из строя, оставляют налет на волосах и коже человека, создавая неприятное ощущение их «жесткости».
Жесткость воды, используемой для приготовления различных продуктов, четко регламентирована и находится на уровне 0,1-0,2 мг-экв/л.
Жесткая вода образует накипь на стенках нагревательных котлов, батареях и пр., чем существенно ухудшает их теплотехнические характеристики, уменьшает свободное сечение трубопроводов.
Трубопроводы зарастают накипными отложениями настолько, что их производительность падает в несколько раз. Поэтому в тех процессах, где допустимо использование воды с некоторым содержанием солей, ее жесткость ограничивается еще меньшими значениями - 0,03-0,05 мг-экв/л.
Накипь на нагревателях стиральных машин выводит их из строя. При стирке, взаимодействуя с поверхностно-активными веществами (ПАВ) мыла или стиральных порошков, соли жесткости связывают их и требуют большего расхода. Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при покраске, в электрохимии и так далее.
Удаление солей
Процессы извлечения из воды солей Ca 2+ и Mg 2+ в водоподготовке называют умягчением воды.
Относительно селективное удаление солей жесткости из воды может производиться методами:
- термической обработки;
- дистилляции;
- реагентного умягчения;
- вымораживания;
- магнитной обработки;
- ультразвуковой обработки;
- ионного обмена;
- обратного осмоса.
Также известны методы обработки воды (электромагнитное воздействие, добавление полифосфатов или других «антинакипинов»), позволяющие на время «связать» соли жёсткости, не давая им в течение какого-то времени выпасть в виде накипи. Однако эти методы не нейтрализуют соли жёсткости химически, фактически не удаляют их и поэтому нашли ограниченное применение в водоподготовке технической воды.
Термическое умягчение
Этим способом избавляются от временной жёсткости, обусловленной гидрокарбонатами кальция и магния. При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната:
Ca(HCO 3) 2 = СаСО 3 ↓
+ СО 2 + Н 2 О,
Mg(HCO 3) 2 = Мg 2 (ОН) 2 СО 3 ↓
+3СО 2 + Н 2 О.
В результате, жёсткость воды снижается. Именно поэтому гидрокарбонатную жёсткость называют временной.
С ионами железа реакция протекает сложнее из-за того, что FeCO 3 неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH) 3 , представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении.
Таким образом, при кипячении воды в быту одновременно происходит и процесс частичного её умягчения.
Дистилляция
Дистилляция является традиционным, эффективным и надежным методом, обеспечивающим высокую степень очистки высокоминерализованных вод с большим солесодержанием и жёсткостью.
Общий принцип получения воды этим методом заключается в следующем: питьевая вода, прошедшая предварительную подготовку, поступает в дистиллятор, состоящий из трех основных узлов: испарителя, конденсатора и сборника.
Испаритель с водой нагревают до кипения. Пары воды поступают в конденсатор, где они сжижаются и в виде дистиллята поступают в сборник. Все нелетучие примеси, находившиеся в исходной воде, остаются в дистилляторе.
Для получения очищенной воды используют дистилляторы, которые отличаются друг от друга по способу нагрева, производительности и конструктивным особенностям.
Метод однократной дистилляции неэкономичен, так как при его использовании велики энергозатраты на нагрев и испарение (около 3000 кДж на 1 кг пара), а также затраты воды на конденсацию пара (около 8 л воды 1 кг пара). Поэтому использование однократной дистилляции целесообразно для малых потреблений воды - 10-20 л/ч.
Более эффективными и экономичными, по сравнению с обычной дистилляцией, являются высокоэффективные многоколоночные дистилляторы. Но они чрезвычайно дороги, к тому же высоки затраты на предподготовку воды для них.
Стоит отметить, что метод дистилляции удаляет все растворённые соли в исходной воде.
Применение реагентов
Различают умягчение воды известкованием, содо-известкованием и содово-натриевый метод умягчения воды.
При известковании в раствор добавляют гашеную известь Ca(OH) 2 до рН около 10. В результате протекают реакции:
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 + 2Н 2 O,
Mg(HCO 3) 2 + 2Ca(OH) 2 = Mg(OH) 2 + 2СaCO 3 + 2Н 2 O.
Данный способ используют при высокой карбонатной и низкой некарбонатной жесткости воды, когда требуется одновременное снижение жесткости и щелочности. Остаточная жесткость на 0,4-0,8 мг-экв/л превышает некарбонатную жесткость.
При содо-известковании в воду добавляют гашеную известь Ca(OH) 2 и соду Na 2 CO 3 до рН около 10. В результате протекают реакции:
Ca(HCO 3) 2 + Ca(OH) 2 + Na 2 CO 3 = 2CaCO 3 + 2NaOH + Н 2 СО 3 ,
Mg(HCO 3) 2 + 2NaOH = Mg(OH) 2 + 2NaHCO 3 .
Как следует из уравнений реакций, в процессе образования и осаждения осадка из воды извлекаются соли жесткости. Вместе с ними удаляются коллоидные и взвешенные частицы с ассоциированными на них загрязнениями. На хлопьях осадка частично сорбируются органические загрязнения воды.
При содо-известковании за счет избытка ионов HCO 3 достигается бoльшая полнота удаления из воды солей жесткости. Повышение температуры до 70-80 °С позволяет довести остаточную жесткость до 0,35-1,0 мг-экв/л. Того же результата можно достигнуть увеличением доз реагентов.
Содово-натриевый метод
Добавление соды необходимо в том случае, если некарбонатная жесткость больше чем карбонатная. При равенстве этих параметров добавление соды может и не понадобиться совсем.
Гидрокарбонаты кальция и магния в реакции со щелочью образуют малорастворимые соединения кальция и магния, соду, воду и углекислый газ:
Ca(HCO 3) 2 + 2NaOH = CaCO 3 ↓
+ Na 2 CO 3 + 2H 2 O,
Mg(HCO 3) 2 + 2NaOH = Mg(OH) 2 ↓
+ Na 2 CO 3 + H 2 O + CO 2 .
Образовавшийся в результате реакции гидрокарбоната магния с щелочью углекислый газ снова реагирует с щелочью с образованием соды и воды:
CO 2 + NaOH = Na 2 CO 3 + H 2 O.
Некарбонатная жесткость
Сульфат и хлорид кальция реагирует с образовавшейся в реакциях карбонатной жесткости и щелочи содой и добавленной содой с образованием не прикипающего в щелочных условиях карбоната кальция:
CaCl 2 + Na 2 CO 3 = CaCO 3 ↓
+ 2NaCl,
CaSO 4 + Na 2 CO 3 = CaCO 3 ↓
+ Na 2 SO 4 .
Сульфат и хлорид магния реагируют со щелочью, образуя выпадающий в осадок гидроксид магния:
MgSO 4 + 2NaOH = Mg(OH) 2 ↓
+ Na 2 SO 4 ,
MgCl 2 + 2NaOH = Mg(OH) 2 ↓
+ 2NaCl.
Ввиду того, что в реакциях гидрокарбоната со щелочью образуется сода, которая в дальнейшем реагирует с некарбонатной жесткостью, ее количество необходимо коррелировать в соотношении карбонатной (Жк) и некарбонатной (Жнк) жесткости:
- при их равенстве соду можно не добавлять;
- при условии Жк > Жнк образуется избыток соды;
- при соотношении Жк < Жнк - недостаток соды и ее необходимо добавлять.
Процессы осаждения осуществляются в отстойниках и осветлителях со взвешенным слоем осадка.
Отстойники малопроизводительны, и получаемая в них гидроксидная пульпа имеет высокую влажность - 97-99%. Поэтому они в настоящее время практически не применяются.
На практике используются различные варианты осветлителей со взвешенным слоем осадка. В них очищаемый раствор подается снизу и проходит через слой осадка. Это увеличивает коэффициент очистки воды.
Реагентные методы в подготовке питьевой воды не используются. После них вода имеет сильнощелочную реакцию. Поэтому реагенты широко применяются в энергетике и промышленности как первая ступень очистки до механических фильтров. При совместной работе они позволяют умягчить воду, удалить взвешенные вещества, включая коллоиды, и частично очистить воду от органических веществ.
Вымораживание
Для борьбы с постоянной жёсткостью воды используют такой метод, как вымораживание льда. Для этого необходимо просто постепенно замораживать воду. Когда останется примерно 10% жидкости от первоначального количества, необходимо слить не замершую воду, а лёд превратить обратно в воду. Все соли, которые образуют жёсткость, остаются в незамерзшей воде.
Наряду с дистилляцией, это одновременно один из способов опреснения высокоминерализованных вод до питьевого качества.
Другие методы
Метод электродиализа основан на явлении направленного движения ионов электролита к электродам, подключенным к сети постоянного тока. Таким образом, ионы металлов, обуславливающие жесткость воды, задерживаются у электродов и отделяются от воды, выходящей из аппарата водоочистки.
Магнитно-ионизационный метод также использует явление направленного движения ионов, но уже под действием магнитного поля. Для увеличения в воде количества ионов ее предварительно облучают ионизирующим излучением.
Магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. В результате этого происходит уменьшение степени гидратации растворенных веществ и их объединение в более крупные частицы, которые выпадают в осадок.
Ультразвуковая обработка воды также приводит к образованию более крупных частиц растворенных веществ с образованием осадка.
Ионообменный способ и обратноосмотические процессы целесообразно подробно рассмотреть во второй части статьи, которую мы опубликуем в нашем журнале в следующем номере.






